广岛大学牵头、福山大学、北海道大学和北里大学参与的研究团队报告称,冬眠叙利亚仓鼠的骨骼肌干细胞(卫星细胞,SCs)在冬眠期间通过抑制激活与再生过程,维持其存活与功能能力。研究人员表示,该发现有助于理解长期低温条件下肌肉组织的维持机制,并为未来潜在治疗应用提供线索。相关论文已发表于《FASEB Journal》。

研究团队指出,冬眠动物在冬眠期间即便缺乏食物,仍能维持肌肉质量;而在一般情况下,骨骼肌在长期不活动或低温环境中往往会出现明显萎缩,并伴随再生能力受损。围绕“肌肉再生关键细胞如何适应冬眠严酷环境”的问题,广岛大学生物医学与健康科学研究生院副教授宫崎光典表示,理解这一机制具有重要意义,因为衰老、长期卧床或疾病相关的肌肉流失是临床关注的难题,而冬眠动物提供了可供研究的自然模型。
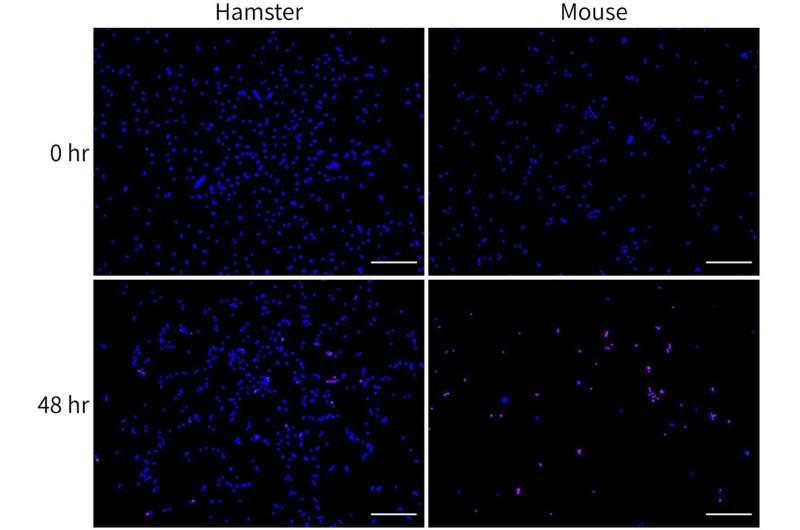
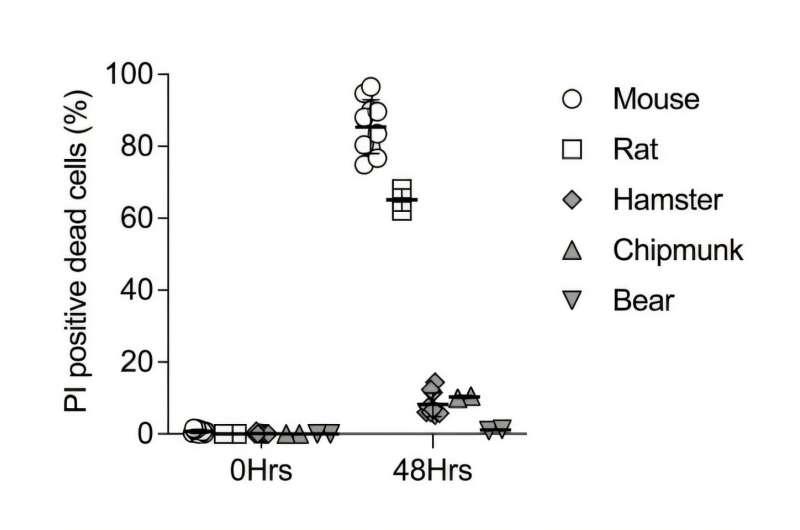
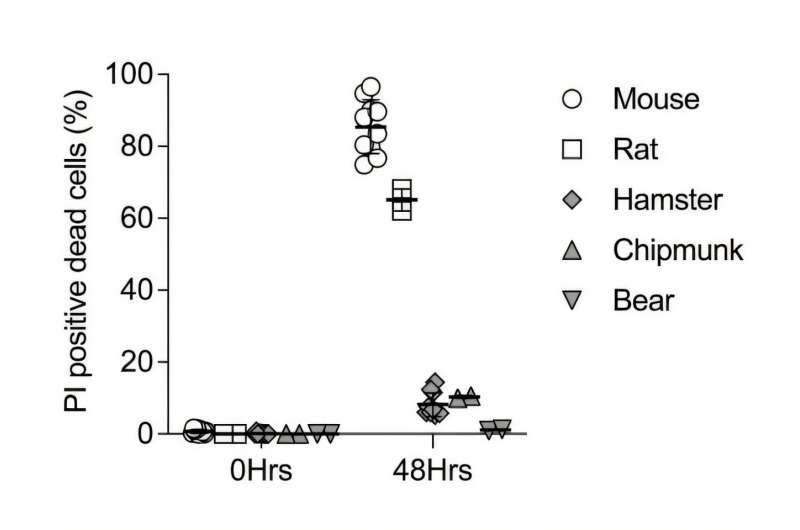
在实验设计上,研究团队从叙利亚仓鼠、花栗鼠和黑熊等冬眠物种,以及大鼠和小鼠等非冬眠物种中分离卫星细胞并建立培养体系,比较其对冷诱导细胞死亡(CICD)的抵抗能力。结果显示,非冬眠动物的卫星细胞对CICD更为敏感,而冬眠物种及冬眠状态下的细胞表现出更强的抵抗力。
研究还发现,谷胱甘肽过氧化物酶4(GPX4)在叙利亚仓鼠卫星细胞中含量较为丰富。该酶与抵御氧化应激、抑制一种被称为“铁死亡”的程序性细胞死亡相关。研究团队据此提出,叙利亚仓鼠的CICD与铁死亡机制有关。
在基因表达层面,RNA分析显示,冬眠叙利亚仓鼠卫星细胞中与肌肉生成相关的基因表达下调;同时,调控卫星细胞激活以及肌肉组织分化的基因也在冷暴露条件下出现下调。
围绕肌肉再生的实验进一步表明,冬眠会抑制卫星细胞的再生性激活,并使受伤后的肌肉再生过程延缓;炎症反应也呈现减弱与受抑制的特征。宫崎光典表示,研究传递的关键信息在于:冬眠动物在维持卫星细胞存活的同时,选择性抑制其再生活性;在寒冷与冬眠期间,激活、分化、炎症以及肌肉再生均明显受抑制,显示其处于一种节能状态。
研究团队表示,下一步将聚焦于阐明冬眠期间在缺乏活跃再生的情况下如何维持骨骼肌,并识别调控这一状态的分子机制。研究人员称,相关认识有望为在长期不活动状态下维持肌肉质量与功能的策略提供参考,应用场景包括疾病卧床、受伤导致活动受限、衰老以及长时间太空旅行等。












